来源:药事纵横 时间:2020/1/13 19:56:30阅读: 次
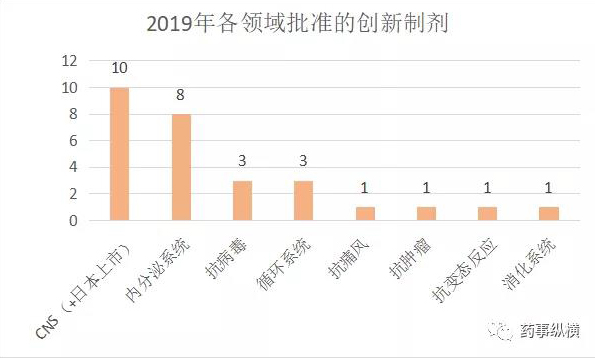
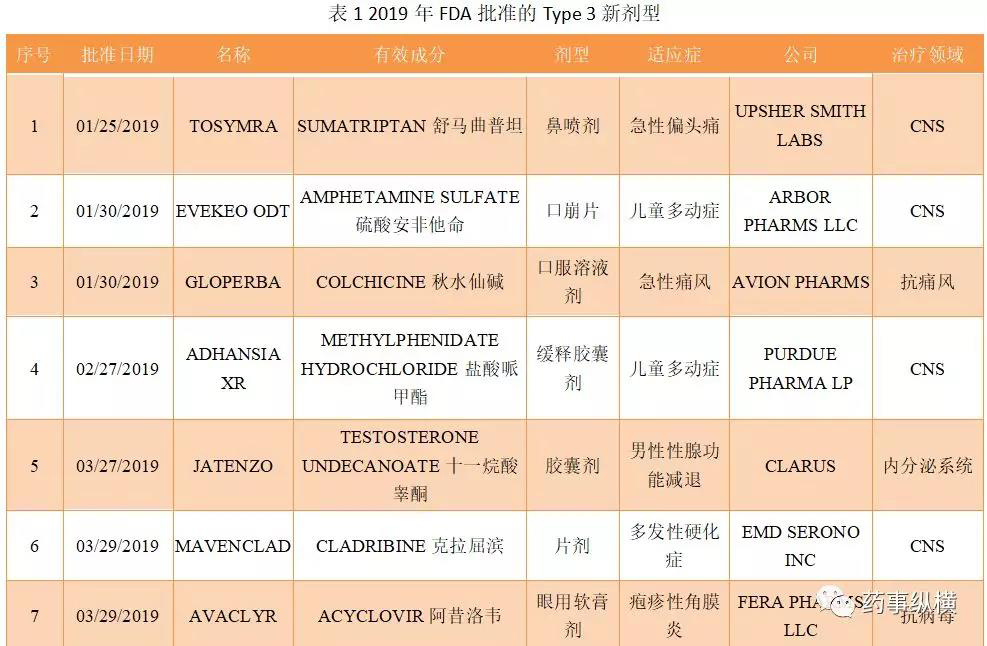
2019年,FDA批准了26款创新制剂(Type 3 - New Dosage Form),其中CNS和内分泌系统领域都有8款获批,堪称创新制剂最活跃的领域。如果加上日本获批的2款透皮贴剂(布南色林和罗匹尼罗),CNS领域就有10款创新制剂上市,其次是内分泌系统8款。这表明CNS和内分泌领域有明显未满足的临床需求。
长久以来,CNS领域的新分子实体研发以失败率最高著称,这让大家的目光转移至创新制剂的研发。10款CNS的创新制剂分别治疗急性偏头痛、儿童多动症、多发性硬化症、精神分裂症和肌萎缩侧索硬化症。具体治疗领域的创新剂型分布如下:
出乎意料的,片剂是2019年批准最多的新剂型,分别从注射液、胶囊剂改良而来,提高了患者顺应性,如Mavenclad(cladribine,克拉屈滨片)是首个也是唯一一个获FDA批准、在2年内最多口服20天即可提供2年疗效的口服多发性硬化症(MS)药物,而它最初上市的是注射剂。又如首款治疗2型糖尿病的口服GLP-1受体激动剂索玛鲁肽片,为全球糖尿病患者的福音。
鼻喷剂起效更快,使用方便,如TOSYMRA(sumatriptan舒马曲坦鼻喷剂)让舒马曲坦能够迅速被吸收进入血液循环,达到与皮下注射的舒马曲坦剂型相仿的药代动力学特征。从而能够迅速生效,缓解疼痛症状。
口服溶液剂则更灵活的调整剂量,如ROMEG Therapeutics的秋水仙碱口服液GLOPERBA。GLOPERBA是第一个获得FDA批准、用于治疗急性痛风的秋水仙碱口服液。
秋水仙碱对肾脏和肝脏有明显副作用,使用秋水仙碱治疗急性痛风经常需要调整剂量甚至中断治疗。与已上市的秋水仙碱胶囊相比,GLOPERBA口服液便于调节剂量。另外,对于吞咽困难的患者,GLOPERBA口服液有良好的服药依从性。
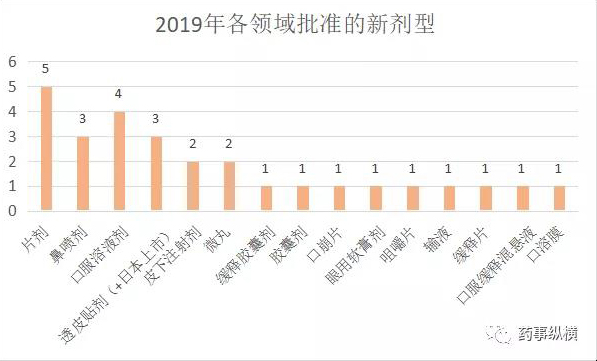
对于国内新药立项来讲,CNS领域的创新制剂研发值得关注。口服溶液剂、鼻喷剂和透皮贴剂则是值得关注的剂型。

2019年1月,FDA批准Tosymra治疗成人偏头痛患者头痛发作的急性疗法。Tosymra是一款鼻喷雾剂,它使用Aegis Therapeutics公司的Intravail技术,增强了药物的渗透能力。这一疗法的主要成分为舒马曲坦(sumatriptan,10mg)。舒马曲坦是一种选择性5-HT1B / 1D受体激动剂。
这一创新配方让舒马曲坦能够迅速被吸收进入血液循环,达到与皮下注射的舒马曲坦剂型相仿的药代动力学特征。从而能够迅速生效,缓解疼痛症状。
在一项多中心,随机双盲,含安慰剂对照的临床试验中,107名偏头痛患者接受了Tosymra或安慰剂的治疗。试验结果表明,Tosymra能够显著降低偏头痛发作时的头痛程度和相关症状。Tosymra组43.8%的患者接受治疗后2小时达到疼痛缓解,而安慰剂组达到这一标准的患者比例只有22.5%(p<0.05)。与安慰剂相比,Tosymra同时显著改善最困扰患者的其它症状,包括恶心和怕光/声(70.7%比39.5%,p<0.01)。

Evekeo ODT由Arbor Pharms Llc研发,于2019年1月30日获FDA批准上市,为一硫酸安非他明口腔崩解片,适用于治疗6至17岁患有注意力缺陷多动障碍(ADHD)的青少年儿童。
ADHD是一个全球性的问题,国内外患病率相近,国内报道患病率为4.31%~5.83%,国外报道为3%-6%,男孩多于女孩,男女患病率之比为4~9∶1。针对ADHD治疗的首选药物是中枢兴奋剂,如哌甲酯有短效(利他林)与长效制剂(专注达、择思达)。其次还有 (丙咪嗪、舍曲林、氟伏沙明、安非他酮等) 。
2019年2月,ROMEG Therapeutics宣布秋水仙碱口服液GLOPERBA获得FDA批准。GLOPERBA是第一个获得FDA批准、用于治疗急性痛风的秋水仙碱口服液。

痛风,又称代谢性关节炎,是一种常见且复杂的关节炎类型。秋水仙碱是治疗急性痛风的常用药。它通过抑制发炎部位的白细胞聚集,使白细胞吞噬尿酸的作用减弱,减轻急性痛风的反应,达到迅速止痛的目的。但是,秋水仙碱对肾脏和肝脏有明显副作用,使用秋水仙碱治疗急性痛风经常需要调整剂量甚至中断治疗,以解决药物与其他治疗(例如肾透析)的相互作用。怎样调整秋水仙碱的剂量,满足肾脏和肝脏有损伤的痛风患者的需求是一个亟需解决的难题。与已上市的秋水仙碱胶囊相比,GLOPERBA口服液便于调节剂量。另外,美国大约有15%的老年患者吞咽困难,无法吞服固体药丸,GLOPERBA口服液有良好的服药依从性。

Adlon制药公司近日宣布美国食品和药品监督管理局(FDA)已经批准Adhansia XR™,用于治疗六岁及以上注意缺陷多动障碍(ADHD)的患者。在AWE研究中,Adhansia XR在给药后的第1、2、5、8、11和16小时显示出相对于安慰剂的统计学显著改善。
注意缺陷多动障碍(ADHD)是一种神经发育型精神障碍。患者特点是注意力不集中,多动和/或冲动,情绪调节也经常出现问题。在儿童中,ADHD可能导致患儿在学校表现不佳。此外,ADHD的发病还与其他精神障碍和滥用药物有关。
2019年3月,FDA批准Mavenclad(cladribine,克拉屈滨片),用于复发缓解型多发性硬化症(RRMS)和活动性继发进展型多发性硬化症(SPMS)成人患者的治疗。Mavenclad是首个也是唯一一个获FDA批准、在2年内最多口服20天即可提供2年疗效的口服多发性硬化症(MS)药物。
cladribine是一种嘌呤类似物,可以选择性抑制免疫系统。该药在化学结构上模仿了腺苷,从而抑制腺苷脱氨酶,干扰了细胞合成DNA的能力。cladribine只由淋巴细胞激活,非激活的cladribine会很快从所有其他细胞中移除。
多发性硬化症中心联盟(CMSC)首席执行官June Halper表示,“FDA对Mavenclad的批准对于患有RRMS和活动性SPMS的人来说是个大好消息。Mavenclad提供了一个新的、有效的治疗选择,不同于目前任何其他药物的口服给药方案,无需注射,一年服药不超过10天。Mavenclad将成为MS患者群体中的一种受欢迎的口服疗法。CMSC祝贺默克公司将Mavenclad作为第一个短程口服治疗选择带到美国。”
Nayzilam是FDA批准的首个也是唯一一个通过鼻腔给药治疗癫痫丛集发作的疗法,也是美国市场20多年来批准治疗癫痫丛集发作的首个新药,其鼻腔喷雾给药方式可为目前治疗选择有限的患者及其照料者提供一种新的解决方案。
Nayzilam(midazolam,咪达唑仑)是一种经鼻腔给药的苯二氮卓类药物,适用于12岁及以上癫痫患者,用于频繁发作活动(如癫痫丛集发作、急性反复发作)间歇性、刻板性发作的紧急治疗。
Nayzilam是一种短效药物,通过鼻腔喷雾治疗癫痫丛集发作,该药旨在作为便于患者携带的一次性疗法,可由非医疗专业人员在患者发生癫痫丛集发作时给药治疗。

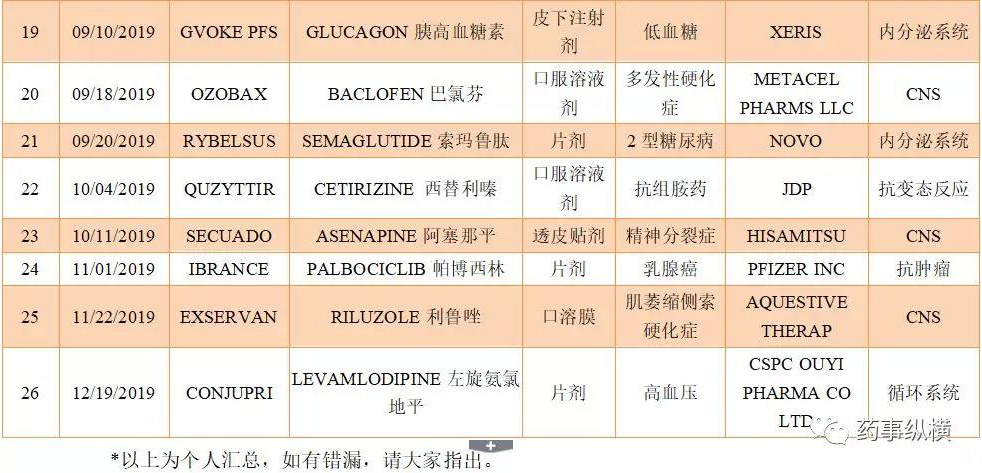
Rybelsus是口服版semaglutide在美国市场的品牌名,特别值得一提的是,该药是全球首个也是唯一一个无需注射即可使用的胰高血糖素样肽受体蛋白(GLP-1)治疗药物。FDA批准非胰岛素口服药Rybelsus,与饮食和运动相结合,用于改善成人2型糖尿病患者的血糖控制。该药每日口服一次,批准的治疗剂量有7mg和14mg。
作为全球首个口服版GLP-1受体激动剂,Rybelsus具有非常好的商业前景,EvaluatePhamra预测,Rybelsus在2024年预计销售额将达到32.3亿美元。
semaglutide(索马鲁肽)是一款新的长效胰高血糖素样肽-1(GLP-1)类似物,以葡萄糖浓度依赖性机制促胰岛素分泌并抑制胰高血糖素分泌,可使2型糖尿病患者血糖水平大幅改善,并且低血糖风险较低。同时,semaglutide还能够通过降低食欲和减少食物摄入量,诱导减肥。除此之外,semaglutide还能够显著降低2型糖尿病患者重大心血管事件(MACE)风险。
FDA批准久光制药旗下的Noven Pharmaceuticals公司研发的透皮给药系统Secuado(asenapine)上市,用于治疗精神分裂症成人患者。
阿塞那平是一种公认的精神分裂症治疗方法药物。而Noven每天一次的透皮给药系统(TDDS)在非典型抗精神病药物阿塞那平的使用时间(24小时)中持续提供血药浓度。与口服或注射制剂相比,透皮贴剂疗法的侵入性相对较低,耐受性更好。使用简单,由患者便可轻松完成。减少了给药频率,大幅度提高了患者的用药依从性。
值得一提的是,2019年全球批准了3款CNS领域的透皮疗法,除了FDA批准的Secuado(asenapine),还有日本PMDA也批准了2款。
|
商品名
|
通用名
|
适应症
|
公司
|
日期
|
|
LONASEN Tape
|
布南色林blonanserin
|
精神分裂症
|
日本住友
|
2019.06
|
|
HARUROPI TAPE
|
罗匹尼罗Ropinirole
|
帕金森病
|
久光/发酵麒麟
|
2019.09
|

12月20日,石药集团宣布,FDA批准CONJUPRI用于治疗高血压。此为中国医药企业率先向美国FDA递交的新药上市申请并经过FDA正常审批途径,成为首获FDA完全批准的中国本土创新药。
左旋氨氯地平为用于治疗高血压的纯化(S)-氨氯地平,即氨氯地平((R)-及(S)-氨氯地平的消旋混合物)中具有药理活性的对映异构体。氨氯地平是由辉瑞于1992年首先开发,并以NORVASC®(苯磺酸氨氯地平)2.5毫克、5.0毫克及10.0毫克片剂进行推广销售的第三代钙通道阻滞剂。而CONJUPRI片剂为1.25毫克、2.5毫克及5.0毫克。
石药集团自2003年起已于中国推广销售马来酸左旋氨氯地平片(商品名:玄宁)。马来酸左旋氨氯地平片在美国的临床开发是依据中国的安全及疗效数据,以及显示左旋氨氯地平比氨氯地平有较少不良反应的数据。
对于创新制剂,2019年最大的遗憾在抗病毒领域。FDA拒绝批准葛兰素史克开发的每月一次HIV复方注射剂Cabenuva(cabotegravir/rilpivirine)。GSK旗下ViiV Healthcare公司收到FDA的完整答复函。FDA给出的原因是与“化学生产和控制(CMC)”有关。Cabenuva的两项关键3期临床试验研究显示,Cabenuva抑制HIV的效果,与每日口服3种药物的标准口服抗逆转录病毒方案相当。Cabenuva是全球首款长效艾滋病药物。看来想要减轻用药负担,艾滋病病毒感染者不得不继续等待。
参考文献
1. 没拿到圣诞“礼物”!GSK长效HIV注射剂遭FDA拒绝,新浪医药新闻
2. 美国FDA批准Tosymra上市作为治疗偏头痛患者头痛发作的急性疗法,搜狐
3. 【独家】1-2月|FDA批准新药概况,药智网
4. 首个秋水仙碱口服液GLOPERBA获FDA批准上市 急性痛风患者福音,动脉网
5. FDA批准用于治疗ADHD的Adhansia XR(盐酸哌甲酯)缓释胶囊CII,梅斯
6. 首个短程口服药物!默克Mavenclad(克拉屈滨片)获美国FDA批准,治疗2类多发性硬化症,生物谷
7. 20年首个新药!优时比新型癫痫药Nayzilam获FDA批准,新浪医药新闻
8. FDA批准首个口服GLP-1受体激动剂Rybelsus,用于治疗2型糖尿病,搜狐
9. 3款新型透皮贴剂获批:适应症全是精神/神经疾病,新药前沿
10. 石药集团马来酸左旋氨氯地平获美国FDA新药上市批准,石药集团
11. 各公司官网
12. FDA官网