来源:奇点糕 时间:2020/12/14 23:35:48阅读: 次
近日,德国夏瑞蒂医学院Frank L. Heppner领衔的研究团队在著名期刊《自然·神经科学》上发表的一项重要研究成果,又引起了人们对新冠病毒的关注,尤其是在疫情还很严重的西方国家。
Heppner和他的同事通过尸检分析,首次获得了鼻咽组织细胞内部存在新冠病毒颗粒的电子显微镜图像,表明新冠病毒有可能从鼻子经由神经细胞进入大脑[1]。

实际上,新冠疫情爆发没多久,科学家就意识到新冠病毒可能会入侵神经系统。
现在已经有很多证据表明,新冠病毒不仅影响呼吸道,还影响中枢神经系统。新冠病毒对神经系统的影响导致三分之一以上的新冠肺炎患者出现嗅觉和味觉丧失、头痛、疲劳、恶心和呕吐等神经系统症状[2,3]。此外,急性脑血管病和意识障碍也有相关研究报道[4]。
科学家已经发现,新冠病毒主要是利用S蛋白与细胞受体血管紧张素转换酶2(ACE2)结合,并通过丝氨酸蛋白酶TMPRSS2的作用,最终进入人体的宿主细胞[5]。之前的动物研究表明,SARS-CoV在表达人ACE2的小鼠鼻内感染后能够进入大脑[6,7]。
已经有研究表明,ACE2在人中枢神经系统中的神经元和胶质细胞中表达[8]。而在人类嗅粘膜中,在生理条件下ACE2由非神经元细胞表达[9]。
最近也有研究在大脑和脑脊液(CSF)中发现了新冠病毒RNA的存在,但仍缺乏新冠病毒真正感染的证据[10,11]。
因此,通过尸检对大脑和外周组织进行系统的分析,以了解新冠病毒进入中枢神经系统端口和在中枢神经系统中的分布情况,就显得非常重要[12]。
因此,Heppner和同事们研究了33名(22名男性和11名女性)死于新冠感染患者的尸检材料,所有死者的死亡中位年龄为71.6岁(30-98岁),从新冠肺炎症状出现到死亡的时间为4-79天,中位时间为31天。
从临床记录来看,这些死者曾表现出的新冠肺炎相关的神经系统改变包括:意识障碍、脑室内出血、头痛和行为改变;还有2人出现了急性脑缺血。此外,在神经病理尸检时,还发现6人有急性梗死。
研究人员详细分析了死者的多个组织样本,包括鼻咽部和多个脑区,并对采样区域做了详细的标记,它们分别是:嗅黏膜(R1)、嗅球(R2)、嗅结节(R3)、口腔黏膜(R4)、三叉神经节(R5)、延髓(R6)和小脑(R7)等区域。
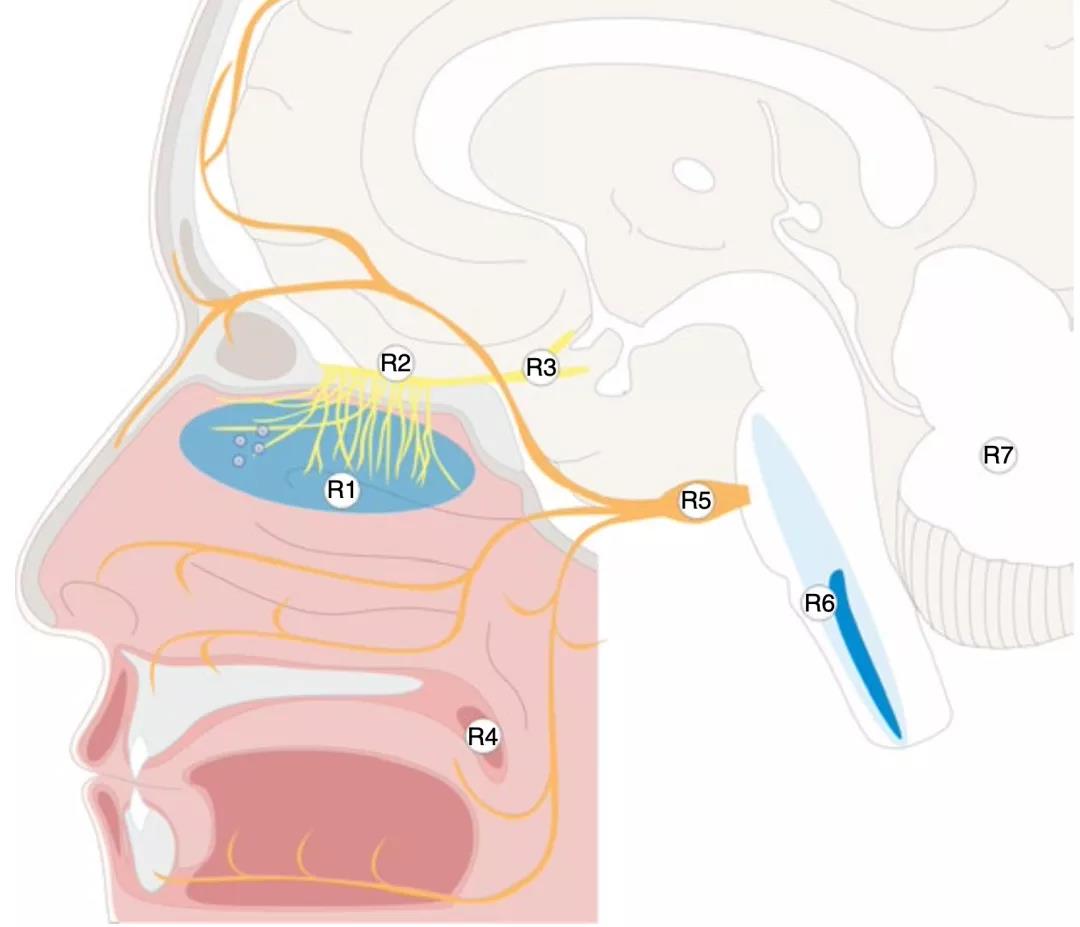
随后,通过RT-qPCR对区域性组织样本的病毒载量进行评估。结果显示,新冠病毒载量最高的部位是嗅黏膜(R1)。
在对比不同死者的组织样本之后,研究人员还发现:疾病持续时间与中枢神经系统中可检测到的新冠病毒RNA量成反比,即在疾病持续时间相对较短的新冠肺炎个体中发现有较高的新冠病毒RNA水平,而新冠肺炎疾病持续时间较长的个体通常具有较低的RNA负荷。
考虑到口咽和鼻咽部的神经元、神经纤维和粘膜在解剖学上的距离非常近,以及新冠肺炎患者表现出的嗅觉和味觉改变等临床症状。研究人员认为,新冠病毒正是利用神经-粘膜界面作为进入中枢神经系统的入口。
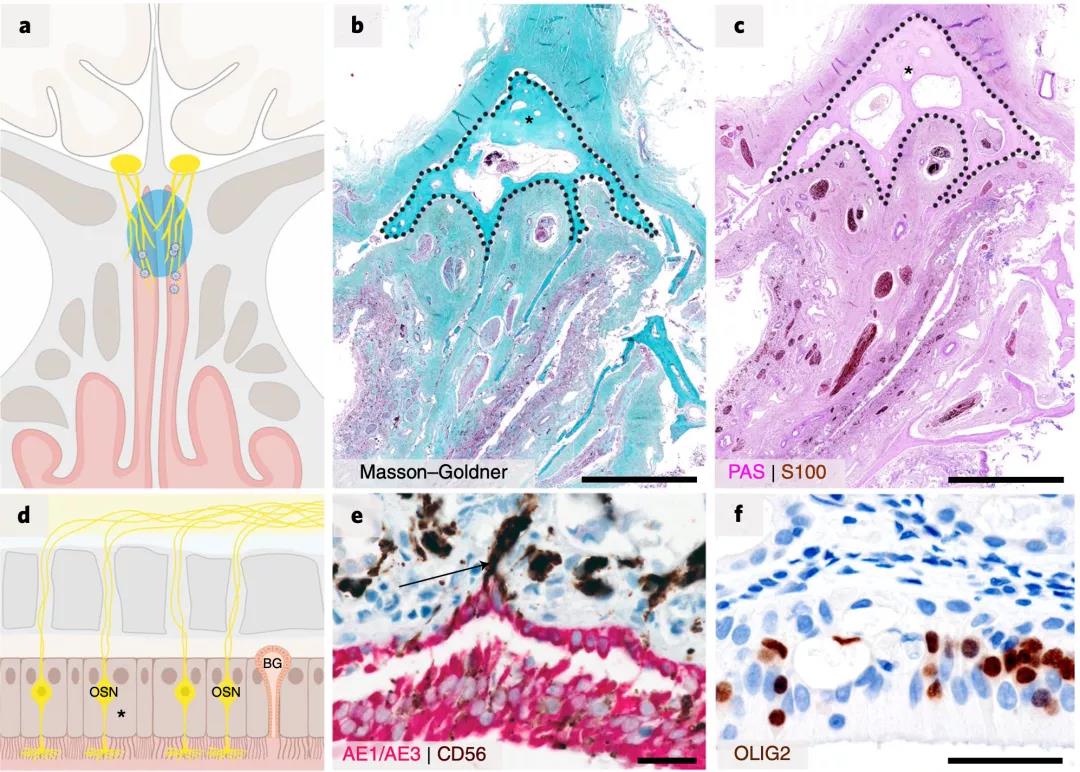
免疫组化、原位杂交和冷冻电镜成像分析发现,在嗅粘膜以及接受嗅道投射的神经解剖区域,存在完整的CoV颗粒和新冠病毒RNA,这再次表明新冠病毒入侵神经可能是通过轴突运输发生的。
为了进一步确定嗅黏膜内哪些细胞里面有新冠病毒,研究人员使用多种神经元标记和SARS-CoV S蛋白进行了共定位研究,确定嗅黏膜内的一些神经细胞(TuJ1+、NF200+或OMP+)内有新冠病毒。
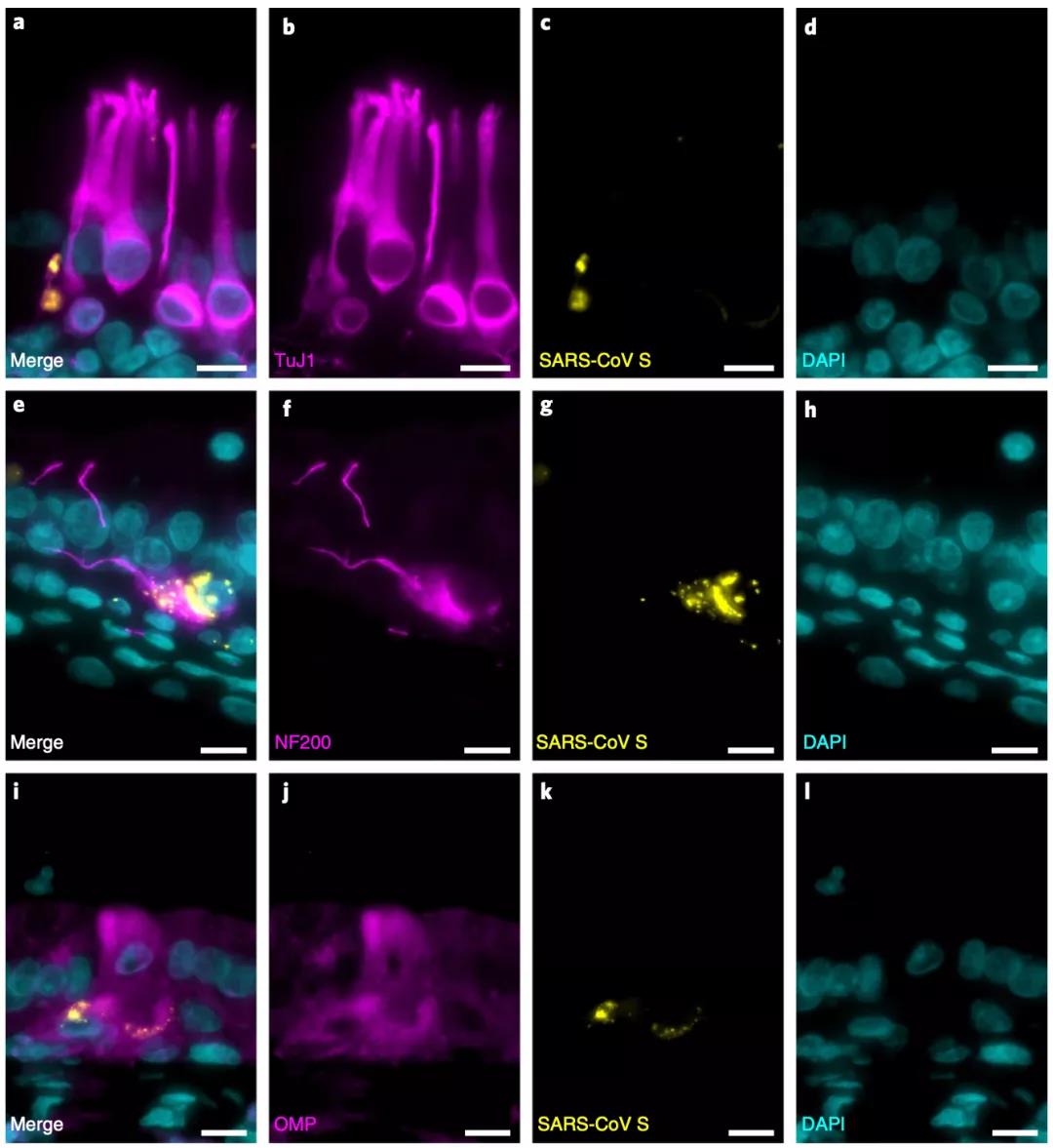
研究人员认为,以上数据支持新冠病毒的部位特异性、局部中枢神经系统感染的假说。而且,研究人员观察到与病毒感染相关的活化巨噬细胞群,这些细胞可以启动和调节免疫级联反应,预示着新冠病毒感染介导了神经炎症反应。
在研究的最后,研究人员在18%的死者脑内确定了微血栓形成与急性区域性脑梗死的组织病理学相关性。而且他们还通过RT-qPCR的方法确定一个可获取的微血栓的新冠病毒RNA检测呈阳性。此外,在一名死者的嗅粘膜中也检测到了微血栓栓塞事件。
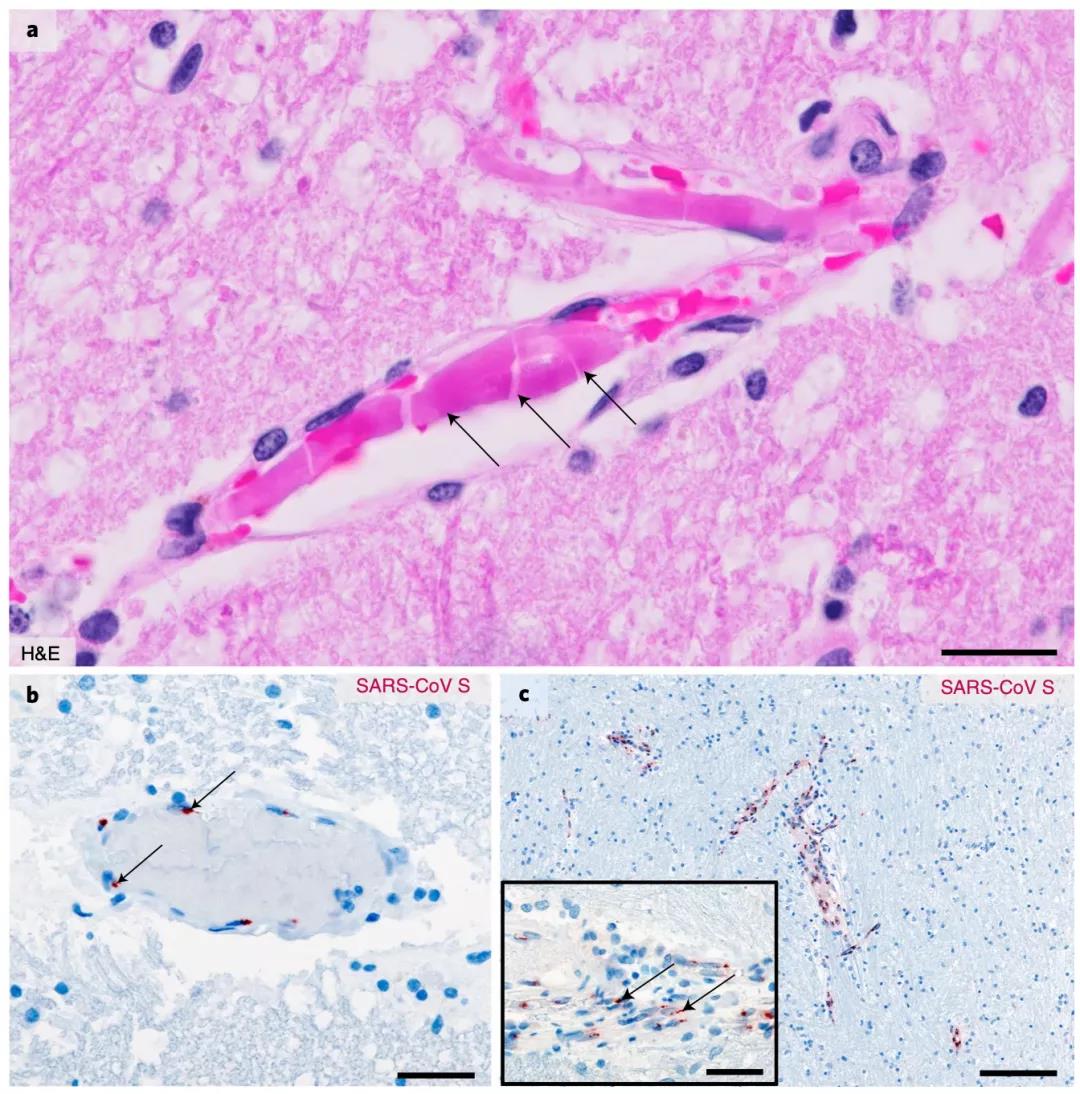
基于以上研究结果,研究人员认为,他们找到了新冠病毒入侵神经的证据,还证明新冠病毒入侵神经可能是通过神经-粘膜界面进入。
这种进入模式,意味着新冠病毒沿着中枢神经攻入大脑,从而解释了新冠肺炎患者表现出的嗅觉和味觉丧失等神经系统症状。
无论如何,新冠疫苗已经初步取得成功,希望人类早日战胜新冠。
参考文献:
[1].https://www.nature.com/articles/s41593-020-00758-5
[2].Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. The lancet, 2020, 395(10223): 497-506.
[3].Conde G, Pájaro L D Q, Marzola I D Q, et al. Neurotropism of SARS-CoV 2: Mechanisms and manifestations[J]. Journal of the neurological sciences, 2020.
[4].Mao L, Jin H, Wang M, et al. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China[J]. JAMA neurology, 2020, 77(6): 683-690.
[5].Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor[J]. Cell, 2020.
[6].Netland J, Meyerholz D K, Moore S, et al. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2[J]. Journal of virology, 2008, 82(15): 7264-7275.
[7].Doobay M F, Talman L S, Obr T D, et al. Differential expression of neuronal ACE2 in transgenic mice with overexpression of the brain renin-angiotensin system[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2007, 292(1): R373-R381.
[8].Khan S, Gomes J. Neuropathogenesis of SARS-CoV-2 infection[J]. Elife, 2020, 9: e59136.
[9].Brann D H, Tsukahara T, Weinreb C, et al. Non-neuronal expression of SARS-CoV-2 entry genes in the olfaory system suggests mechanisms underlying COVID-19-associated anosmia[J]. Science Advances, 2020: eabc5801.
[10].Puelles V G, Lütgehetmann M, Lindenmeyer M T, et al. Multiorgan and renal tropism of SARS-CoV-2[J]. New England Journal of Medicine, 2020.
[11].Moriguchi T, Harii N, Goto J, et al. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2[J]. International Journal of Infectious Diseases, 2020.
[12].Cevik L, Alves M J, Otero J J. Neuropathologists play a key role in establishing the extent of COVID-19 in human patients[J]. Free Neuropathology, 2020, 1: 11-11.